問題文及び解答は経済産業省のHPにある「過去の計量士国家試験問題」から引用しています。
解説は私の見解になります。解説が間違っている可能性もありますので、予めご了承ください。
問11~15の内容は?
「環境計量に関する基礎知識(化学)」の問11~15の内容は以下の通りです。
- 問11 有機化学(異性体)
- 問12 有機化学(酸性度)
- 問13 有機化学(配向性)
- 問14 有機化学(炭化水素)
- 問15 化学電池
問11 有機化学(異性体)
問11
鏡像異性体をもたない分子またはイオンの構造式として、正しいものを一つ選べ。

正解と解説

- 鏡像異性体とは(引用:コトバンク)
- 原子の立体配置が互いに鏡像の関係となっている立体異性体。エナンチオマー。対掌体。鏡像体。
鏡像異性体は互いに、「右手」と「左手」のような「構造は一緒だが重ねることができない」関係にあります。

鏡像異性体かどうかは「不斉炭素原子」の有無で見分けることができるよ!
不斉炭素原子とは結合の4本の手に全て違う原子団がついている炭素のことをいいます。
そして、この不斉炭素原子がある物質は「鏡像異性体」を持ちます。
問題文にある選択肢1を見てみましょう。
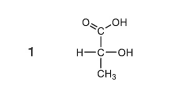
1番上の炭素が結合している原子団は、=O、-OH、-CHOHCH3です。4本の結合の手のうち、2本が同じOと繋がっているため、不斉炭素原子ではありません。
2番目の炭素が結合している原子団は、-COOH、-H、-OH、-CH3で、4本すべて違う原子団のため、「不斉炭素原子」となります。
3番目の炭素は、-CHOHCOOH、-H、-H、-Hで、4本のうち3本がHと繋がっているため、不斉炭素原子ではありません。
以上のことから、選択肢1の物質は「鏡像異性体」を持つ分子になります。
それでは、選択肢3の物質を見てみましょう。

1番上の炭素が結合している原子団は、=O、-OH、-COOHです。4本の結合の手のうち、二重結合である2本が同じOと繋がっているため、不斉炭素原子ではありません。
2番目の炭素も、-COOH、=O、-OHで、Oの二重結合があり、不斉炭素原子ではないことがわかります。
以上のことから、選択肢3の物質は「鏡像異性体」を持たない分子になります。
問12 有機化学(酸性度)
問12
次のカルボン酸(ア)~(エ)について、水中での酸性の強さの順として、正しいものを1~5の中から一つ選べ。ただし、不等号で大きい方が強い酸性を示すものとする。
(ア)CH3COOH
(イ)CF3COOH
(ウ)CH3CH2COOH
(エ)CF3CH2COOH
- (ア)>(ウ)>(イ)>(エ)
- (イ)>(エ)>(ア)>(ウ)
- (ウ)>(イ)>(ア)>(エ)
- (エ)>(ア)>(ウ)>(イ)
- (エ)>(イ)>(ウ)>(ア)
正解と解説
2 (イ)>(エ)>(ア)>(ウ)
カルボン酸(R-COOH)の酸性度は以下の表のとおりです。
表 種々のカルボン酸の酸性度
| 構造 | Ka | pKa |
| CF3CO2H | 0.59 | 0.23 |
| CH3CO2H | 1.75×10-5 | 4.76 |
| CH3CH2CO2H | 1.34×10-5 | 4.87 |
| CH3CH2OH(エタノール) | (1.00×10-16) | (16.00) |
ふっ素Fは水素Hよりも電気陰性度が大きく電子を吸引する力が強いので、酢酸基のH+は遊離しやすくなります。そのため、Kaは低い値となっています。
(イ)CF3COOH >(エ)CF3CH2COOH >(ア)CH3COOH >(ウ)CH3CH2COOH
問13 有機化学(配向性)
問13
フェノールに十分な量の臭素水を加えたとき、得られる主生成物の構造式として正しいものを一つ選べ。

正解と解説

フェノールはベンゼン環にヒドロキシ基が1つ付いた有機化合物です。
ヒドロキシ基は「オルト-パラ配向性活性化基」に分類されています。
- 配向性とは?
- 置換基によって、特定の位置で反応が優先的に起こるようになること。
芳香族化合物の場合、オルト-パラ配向性とメタ配向性の2種類がある。
- 活性化基とは?
- 反応を促進するような置換基のこと。逆に反応を抑制するような置換基は「不活性基」と呼ばれる。
ヒドロキシ基のあるフェノールはオルト位とパラ位に置換が起きやすいです。
よって、フェノールに十分な量の臭素水を加えると、オルト位とパラ位にブロモ基(-Br)がついた
選択肢3の構造式を持つ化合物が主生成物となります。
問14 有機化学(炭化水素)
問14
200℃、300 atmの高温高圧下でエチレンと1,3-ブタジエンとの反応から、主生成物として炭素数6の炭化水素が得られた。この炭化水素の名称として、正しいものを一つ選べ。
- ベンゼン
- ヘキサン
- 1-ヘキセン
- シクロヘキサン
- シクロヘキセン
正解と解説
5 シクロヘキセン
問15 化学電池
問15
燃料電池は化学エネルギーを電気エネルギーに変換する装置で、水素を燃料とする場合、以下の反応が進行する。
H2 + 1/2 O2 → H2O
25℃において水の標準生成ギブズエネルギー△Goが-237 kJ mol-1であるとき、この燃料電池の標準起電力Eoは幾らか。次の中から最も近いものを一つ選べ。ただし、ファラデー定数をF(96500 C mol-1)、化学反応で移動する電子数をnとすると、△Go = -nFEoの関係が成立するものとする。
- 0.41 V
- 0.59 V
- 0.82 V
- 1.23 V
- 2.46 V
正解と解説
4 1.23 V
燃料電池の反応は、
- 負極 H2 → 2H+ + 2e
- 正極 O2 + 4H+ + 4e → 2H2O
この反応では電子2個が移動するため、n=2となります。
問題文から△Go=-237 kJ mol-1、F=96500 C mol-1と示されているので、これらの数値を△Go = -nFEoの式に当てはめて標準起電力Eoを求めると、
Eo=△Go/(-nFEo)= -237×1,000 / (-2×96,500) ≒ 1.23 V
参考文献
おススメ問題集
「環境計量士試験[濃度・共通]攻略問題集 / オーム社」なら、過去7回分の試験問題を、試験科目ごとに分類・整理し、頻出・重要問題を解説しています。
正直、この一冊を完璧にするだけで十分合格可能なレベルの実力を身につけられます。

















コメント