電子配置って何?
電子配置とは、原子の持つ電子がどの軌道に入っているかを示すものです。
電子配置の方法
それぞれの軌道に振り分けられる電子の数は以下の通りです。
- s軌道:2個
- p軌道:6個
- d軌道:10個
- f軌道:14個
そして、原子番号の数ぶん、1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p・・・という順番で電子が入っていきます。
4sよりも3dの方が原子核からの距離は遠いはずなんですが、
この順番は「低エネルギーの電子軌道から電子が入っていく」という原則に従うため、
低エネルギー側である4s軌道の方に優先的に電子が入っていきます。
ただ、電子配置を書く時は1s22s22p63s23p63d14s2の順番で書くので、そこは気をつけましょう。
電子配置の例外も存在する!
Cr(原子番号24)の基底状態の電子配置はどうなるでしょうか?
各元素の電子配置を周期表で確認できるサイトがあります。
確認してみましょう。
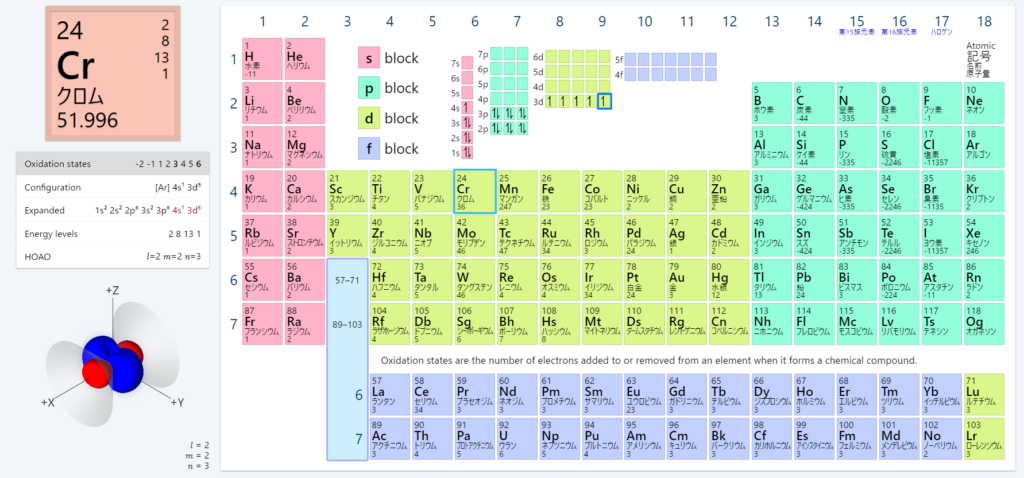
1s22s22p63s23p63d6だと思いきや、
1s22s22p63s23p63d54s1ですね。
なぜなのかというと、
完全に充填されていない3d軌道を占めるより、
4s軌道に電子が入った方が電子間反発が小さくなり、原子全体としてエネルギーが安定するからだといわれています。
そこから
Mn(原子番号25):1s22s22p63s23p63d54s2
Fe(原子番号26):1s22s22p63s23p63d64s2
Co(原子番号27):1s22s22p63s23p63d74s2
Ni(原子番号28):1s22s22p63s23p63d84s2
Cu(原子番号29):1s22s22p63s23p63d104s1
Zn(原子番号30):1s22s22p63s23p63d84s2
の順番で電子配置が決まっていきます。
ここも
「なんでCuの時、4s軌道に1個しか入ってないねん!」
となりますが、
原子全体で考えた時に3dを埋めてしまった方がエネルギーが安定するため、このような電子配置となります。
試験では狙われやすい部分なのでCrとCuの例外パターンは必ず覚えておきましょう。
最後に
電子配置を決めるうえでのルールは以下の通りです。
- 低エネルギーの電子軌道から電子が入っていく
- 同じエネルギーの軌道には、まず電子が1個ずつ重点されて不対電子が最大となるような電子配置をとる(フントの規則)
- 例外のパターンも存在する(CrとCuのパターンは試験に出やすい!)
基本的には基底状態であれば、原子番号の数ぶん電子を軌道にいれていく作業なので、そんなには難しくないのですが、CrやCuなどのイレギュラーなパターンもあるので、そこの部分は注意しましょう。
その他の解説記事はこちら
本サイトでは環境計量士(濃度)の過去の試験問題の正解と解説を行っています。
ぜひ活用してください。
今後も更新していくので、ぜひブックマーク・シェアよろしくお願いします。
どうやって勉強を進めればいいのかわからない方はこちらの記事を読んでみて下さい。

















コメント